鮮蝦食譜飼料使用整隻劍蝦為主原料,含有豐富的蛋白質和天然幾丁質。幾丁質和幾丁聚醣都被稱為甲殼素,但其實是不同物質,幾丁質具增強魚隻免疫力的效果,不影響其營養吸收,適量幾丁質還有助於魚類成長與提供能量,且可作為益生元協助益生菌的增生與作用。
【鮮蝦研究室】劍蝦飼料中的甲殼素是否影響觀賞魚的營養吸收?

台大水生動物博士/鮮蝦食譜研發𝗥&𝗗
上篇分享鮮蝦食譜使用整隻劍蝦作為觀賞魚飼料的主要原料,其營養價值不亞於一般常用的魚粉,可以提供觀賞魚質量俱佳的蛋白質來源,但最大的差別在於整隻劍蝦的原料有較高含量的「甲殼素」,而這當然來自於蝦子的外骨骼,也就是蝦殼。「甲殼素」在動物實驗中被發現具有減少脂質和膽固醇在腸道中吸收的效果,故在人用保健食品的市場中被開發為塑身與調節消化吸收的人用保健食品。也因此,讓人不免會擔心,魚隻攝食較多的甲殼素之後,對食物的營養吸收是不是會有負面的影響。其實,這應該是對「甲殼素」這個中文名稱的混淆所造成的誤解。
◑這個「甲殼素」不是那個「甲殼素」

包含蝦、蟹、昆蟲等節肢類無脊椎動物都有以幾丁質 (Chitin) 為主要成份之一的外骨骼,也就是身體最外層的那層「殼 (shell)」。幾丁質是一種含氮多醣類的聚合物,由一個一個稱為「N-乙醯葡萄糖胺 (N-acetyl glucosamine)」的單體以 (1 -> 4) 醣苷鍵 (β-(1 -> 4)-glycosidic bond) 串接起來,如同鎖鏈般形成長鏈狀 (表1),具有堅韌的特性。幾丁質結合了蛋白質與礦物質,並且以特殊的結構多層次排列,就形成了我們所看到的「殼」(圖1)。而幾丁質,就是中文被稱為「甲殼素」的物質之一。
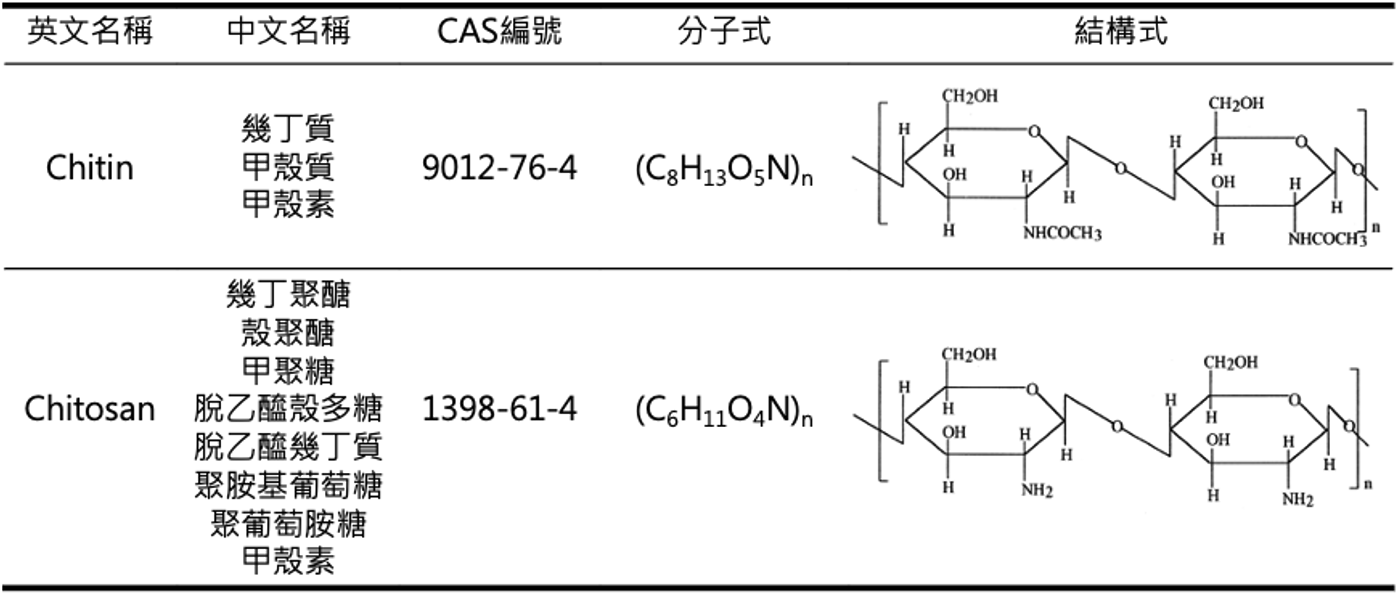 表1.幾丁質和幾丁聚醣分子式與結構式
表1.幾丁質和幾丁聚醣分子式與結構式
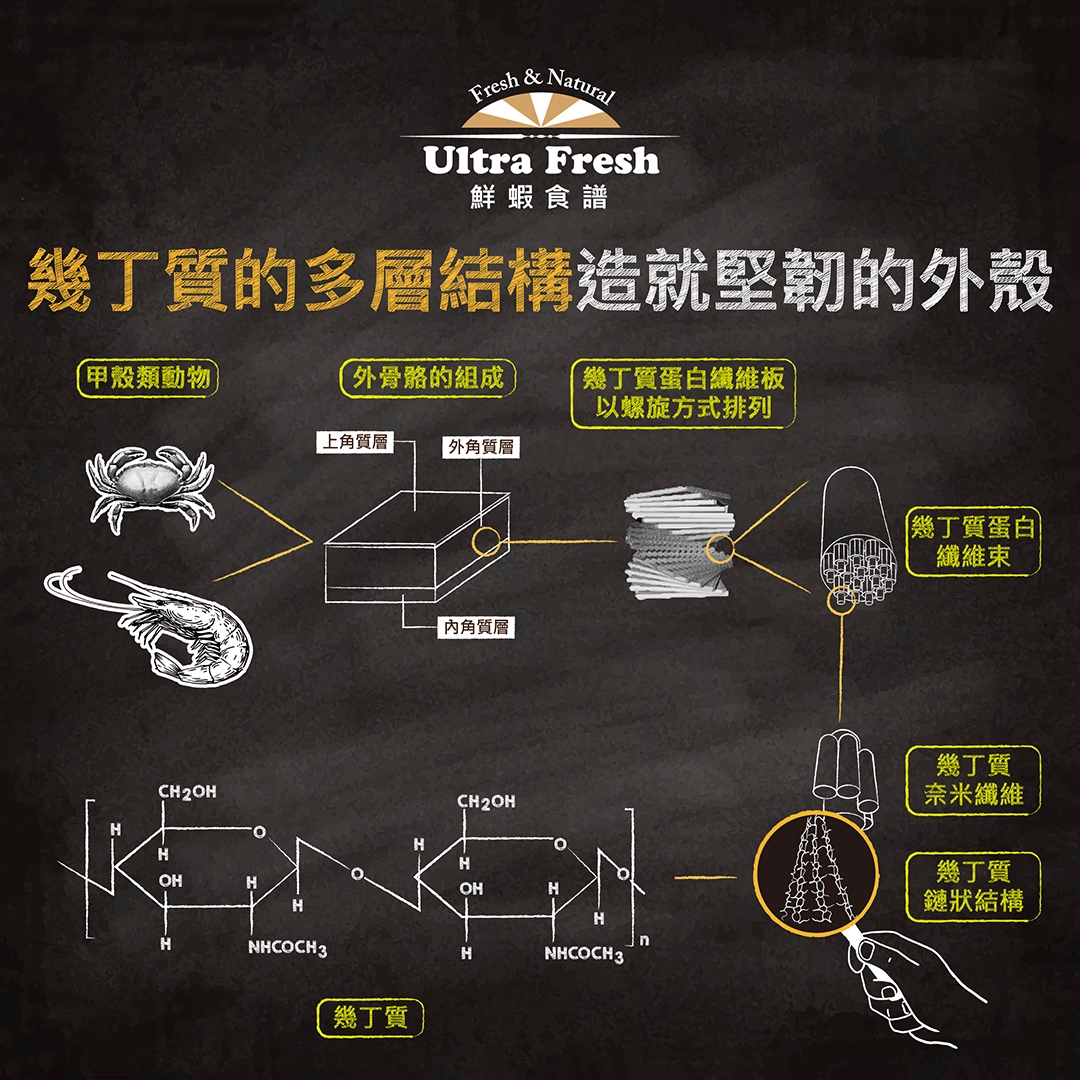 圖1.幾丁質的多層結構
圖1.幾丁質的多層結構
很多人容易將幾丁質與另外一種多醣聚合物混淆—幾丁聚醣 (Chitosan) ,或稱為殼聚醣,商業化後的產品也常同樣被稱為甲殼素 (表1)。幾丁聚醣是幾丁質經過「脫乙醯化作用 (deacetylation)」將單體上的N-乙醯基 (N-acetyl group;-NH-CO-CH3) 脫去並形成胺基 (-NH2) 之後的長鏈狀產物 (圖2)。在絕大部份的情況下,幾丁聚醣是透過生物工程以化學或生物方法將幾丁質脫乙醯化後所生成的。化學方法是以高濃度氫氧化鈉強鹼溶液處理幾丁質;生物方法則是仰賴幾丁質脫乙醯酶 (chitin deacetylase) 作用後再以酸鹼進行純化。幾丁質脫乙醯酶絕大部份僅存在於細菌、真菌等微生物與少部份昆蟲中,經萃取後被應用來生產幾丁聚醣。幾丁質脫乙醯化的程度 (degree of deacetylation) 通常只要達到40%-75%之間,就可以說反應的產物為幾丁聚醣;而市面上作為保健食品銷售的甲殼素產品,幾丁質脫乙醯化的程度則常介於70%-90%之間,有的食品級商品號稱可達95%以上,但就是很難達到幾丁質100%完全脫乙醯化的。這也就是市面上常是混合著幾丁質和幾丁聚醣而統稱為甲殼素販售,以及在討論、研究、應用與行銷宣傳時常會將兩者一併提及的原因。
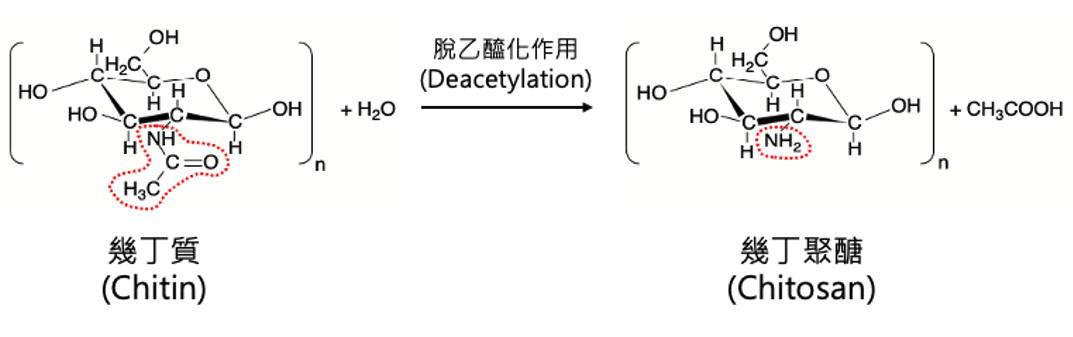 圖2.幾丁質 (Chitin) 脱乙醯化後形成幾丁聚醣 (Chitosan)。圈選處為兩個分子不同的官能基。
圖2.幾丁質 (Chitin) 脱乙醯化後形成幾丁聚醣 (Chitosan)。圈選處為兩個分子不同的官能基。
雖然幾丁質跟幾丁聚醣在中文名稱和長鏈狀結構上相像,但兩者單體上官能基的不同,也導致兩者的性質不同。幾丁聚醣具有容易形成膠膜的特性。科學家們發現依實驗設計刻意餵食實驗動物幾丁聚醣後,牠們的腸道表面會形成膠狀屏障並且留滯脂質和膽固醇,降低它們的吸收,降低血中膽固醇的濃度,甚至還會造成動物成長的抑制。因為如此,坊間以保健食品名義販售的甲殼素產品通常是以阻斷脂肪吸收為主訴,即使人體試驗的結果仍存在爭議。即使中文混淆使用「甲殼素」這個名稱,但值得注意的是,在上述觀察到脂質吸收降低的實驗中,實驗動物們被刻意餵食的是幾丁聚醣,而非幾丁質。
總而言之,蝦蟹等甲殼類動物與昆蟲確實常是生產動物性來源幾丁聚醣的原料,但是在生產流程上是先從這些原料中萃取出幾丁質之後,再透過前述生物工程方法的處理,最終才產出幾丁聚醣。蝦蟹殼中大量含有的是幾丁質,而非幾丁聚醣。雖然近年科學家在幾種甲殼類動物體內發現一些與昆蟲幾丁質脫乙醯酶基因序列相似的基因,並且認為它們的功能與甲殼類脫殼有關,但尚無具體的證據證明這些甲殼類動物體內有幾丁聚醣的存在。
◑別擔心!魚類具有分解幾丁質的能力!

幾丁質雖然結構穩定,質地堅韌,但其實也非完全不可摧。在自然界中就有可以分解幾丁質的酵素,它們可以把長鏈狀結構的幾丁質打斷,再透過其他酵素的一連串作用最終將幾丁質分解成單醣類,作為營養能量的來源之一。主要打斷 (分解) 幾丁質結構的酵素統稱為幾丁質酶 (chitinase),並且可以根據它作用在幾丁質結構上的位置不同至少再細分為內作用幾丁質酶 (Endo-acting chitinase)、外作用幾丁二醣酶 (Exo-acting chitobiosidase)、外作用殼二醣酶 (Exo-acting chitobiase)、β-(1,4) N-乙醯葡萄糖胺酶 (β-(1,4) N-acetyl glucosaminidase) 等好幾種。幾丁質在經過幾丁質酶系統的作用之後,單體之間的鍵結被陸續打斷,形成一個一個N-乙醯-D-葡萄糖胺 (N-acetyl-D- glucosamine) 單體被釋放出來。早在西元1961年,幾丁質酶就已經被證實存在於魚類消化器官和消化液中。在魚類身上,N-乙醯-D-葡萄糖胺被認為會再經過一連串生化作用之後形成果糖-6-磷酸 (Fructose-6-phosphate),並且進入一個稱為糖解作用 (glycolysis) 的新陳代謝途徑裡。研究指出,每1公克的幾丁質可以提供大約17.1千焦耳的能量。某些甲殼類動物光是其幾丁質外骨骼能提供的能量就佔整體的20%以上,對以牠們為食的魚類而言,幾丁質外骨骼是很重要的能量與碳氮元素來源之一。
幾丁質酶在魚體內的分佈位置以消化系統為主,包括胃 (stomach)、幽門垂 (pyloric caeca)、腸 (intestine)、肝臟 (liver)、胰臟 (pancreas)等器官以及消化液。科學家們也發現,幾丁質酶的活性大小在不同魚種與不同器官上多少有不同,目前已知至少跟魚種的食性、主要食物種類、構造上是否能先把食物磨碎後才進入消化道、腸道的長度等都有關係。
◑餵食含有適量幾丁質的飼料對魚隻是有助益的!

魚類實際吃下含有幾丁質的飼料後, 其成長速度究竟會不會受到影響?這是經濟性水產養殖者必定會關心的事。為了解開這個疑慮,水產科學家們很早以前就開始在不同的魚種上進行相關的試驗。綜合文獻上報導的結果,餵食額外添加幾丁質的飼料之後,許多魚類的成長均顯著地增加 (例如嘉鱲 (Pagrus major)、日本鰻 (Anguilla japonica)、鰤魚 (Seriola quinqueradiata)、雪鮭 (Schizothorax richardsonii)、錦鯉 (Cyprinus carpio haematopterus)、尼羅吳郭魚 (Oreochromis niloticus) 等)。在這些試驗中,飼料裡的幾丁質含量比例大約在2% - 10%之間。不過,還是有些魚種在餵食額外添加幾丁質的飼料後成長無明顯的改變 (例如印度金吉羅 (Tor putitora)),或是比無添加幾丁質的對照組生長還差一些的 (例如雜交吳郭魚 (O. nilotucus x O. aureus))。不可否認地,飼料中幾丁質的添加對魚類的成長多少還是會因為測試魚種或添加比例的不同有不同程度的效果,而這被認為跟各魚種對幾丁質的消化與利用能力差異有關。很有趣的一點是,科學家也發現,若飼料中同時添加了幾丁質與益生菌 (probiotics) 的話,幾丁質除了能提供能量給魚隻之外,還可以作為益生元 (prebiotics) 協助益生菌的增生與作用,兩者共存之下對魚隻的成長與抗氧化能力上具有加成的效果。
除了添加純化的幾丁質之外,科學家們也嘗試過直接在飼料中混入甲殼類動物原料 (蝦粉、磷蝦粉等) 或昆蟲 (蠶蛹、黑水虻幼生、蠅蛆、麵包蟲等) 以探討使用這些已知富含幾丁質的原料對魚類生長的影響。這些原料的蛋白質、脂質等營養價值本來就不差。而將這些原料部份或完全取代魚粉製成飼料進行餵食試驗後,魚隻的成長表現一般來說也都不會太差。甚至,因此提高了飼料對魚隻的誘引性,增加了魚隻的進食意願和進食量。
比起成長的速度,觀賞水族玩家肯定會更關心魚隻在自己的水族箱中是否能長時間保持健康而少生病。幾丁質及其衍生物已被證實具有刺激免疫的效果 (immunostimulatory effect),無論是採注射或餵食的方式,都可以增加魚隻非特異性與細胞免疫反應的活性,在對抗真菌、細菌、吸蟲類寄生蟲上都有正面的效果。此外,每日餵食含有幾丁質的餌食也被證實可以增加魚類腸道菌相 (intestinal microbiota) 的多樣性,減少外來病源菌入侵與造成魚隻感染的風險。
◑結語
其實,除了鮮蝦食譜之外,許多國內外觀賞魚品牌也已經注意到幾丁質的好處,並且額外添加至飼料中製成產品。飼料中幾丁質 (以甲殼素、甲殼多醣等名稱) 的添加具有可提升魚隻免疫力的效果,也常成為這些產品的主訴特點之一。不過,鮮蝦食譜飼料產品中的幾丁質來源天然,直接來自於整隻劍蝦,非經化學加工萃取。根據研究,蝦蟹類 (甲殼類) 動物幾丁質含量大致上介於總體重 (乾重) 的2.5% - 8.5%。在鮮蝦食譜目前觀賞魚飼料產品的配方中,包含劍蝦在內等甲殼類動物原料的使用含量介於25% - 60%之間,依產品種類不同而不同。因此,可以換算鮮蝦食譜飼料產品中的幾丁質含量正是落於文獻報導中可觀察到許多魚種成長提高的比例範圍之內。鮮蝦食譜飼料產品使用整隻劍蝦作為主要原料,並且依目標魚種設計搭配多種動植物性原料,可以同時提供魚隻足夠且豐富的營養來源,以及真正天然的幾丁質與誘引因子,在避免各式化學添加劑的使用下,讓寵愛的魚隻們正常且健康地成長。

◑參考文獻
Alfiko Y., Xie D., Astuti R.T., Wong J., Wang L. (2022) Insects as a feed ingredient for fish culture: Status and trends. Aquaculture and Fisheries 7: 166-178.
Baehaki A., Lestari S.D., Wahidman Y., Gofar N. (2017) Characteristics of chitinase isolated from different part of snakehead fish (Channa striata) digestive tract. International Symposium of Food and Agro-biodiversity.
Cauchie H.-M. (2002) Chitin production by aerthropods in the hydrosphere. Hydrobiologia 470: 63-96.
Cavalheiro, J.M.O, de Souza E.O., Bora P.S. (2007) Utilization of shrimp industry waste in the formulation of tilapia (Oreochromis niloticus Linnaeus) feed. Bioresource Technology 98(3): 602-606.
El‐Sayed, A‐F.M. (1998) Total replacement of fish meal with animal protein sources in Nile tilapia, Oreochromis niloticus (L.), feeds. Aquaculture research 29(4): 275-280.
Elserafy S.S., Abdel-Hameid N.-A.H., Abdel-Salam H.A., Dakrouni A.M. (2021) Effect of shrimp waste extracted chitin on growth and some biochemical parameters of the Nile tilapia. Egyptian Journal of Aquatic Biology and Fisheries 25(1): 313-329.
Esteban M.A., Mulero V., Cuesta A., Ortuno J., Meseguer J. (2000) Effects of injecting chitin particles on the innate immune response of gilthead seabream (Sparus aurataL.). Fish & shellfish immunology 10(6): 543-554.
Esteban M. A., Cuesta A., Ortuno J., Meseguer J. (2001) Immunomodulatory effects of dietary intake of chitin on gilthead seabream (Sparus aurata L.) innate immune system. Fish & shellfish immunology 11(4): 303-315.
Fang R., Lundblad G., Lind J., Slettengren K. (1979) Chitinolytic enzymes in the digestive system of marine fishes. Marine Biology 53: 317-321.
Gades, M. D., Stem J.S. (2003) Chitosan supplementation and fecal fat excretion in men. Obesity research 11(5): 683-688.
Gutowska M.A., Drazen J.C., Robison B.H. (2004) Digestive chitinolytic activity in marine fishes of Monterey Bay, California. Comparative Biochemistry and Physiology – A Molecular and Integrative Physiology 139: 351-358.
Jeuniaux, C. (1961) Chitinase: an addition to the list of hydrolases in the digestive tract of vertebrates. Nature 192: 4798.
Kamilya D., Khan M.I.R. (2020) Chitin and chitosan as promising immunostimulant for aquaculture. In: Handbook of Chitin and Chitosan. Pp761-771. Elsevier.
Koide S.S. (1998) Chitin-chitosan: properties, benefits and risks. Nutrition research 18(6): 1091-1101.
Kono M., Matsui T., Shimizu C. (1987) Effect of chitin, chitosan, and cellulose as diet supplements on the growth of cultured fish [red sea bream, eel, yellowtail. Bulletin of the Japanese Society of Scientific Fisheries 53(1): 125-129 (Japan).
Kou S.G., Peters L.M., Mucalo M.R. (2021) Chitosan: A review of sources and preparation methods. International Journal of Biological Macromolecules 169: 85-94.
Kumar R., Kaur N., Kamilya D. (2019) Chitin modulates immunity and resistance of Labeo rohita (Hamilton, 1822) against gill monogeneans. Aquaculture 498: 522-527.
Li X., Diao P., Chu J., Zhou G., Zhou J., Lin H., Chen J., Zeng Q. (2021) Molecular characterization and function of chitin deacetylase-like from the Chinese mitten crab, Eriocheir sinensis. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology 256: 11612.
Lindsay G.J.H. (1984) Distribution and function of digestive tract chitinolytic enzymes in fish. Journal of Fish Biology 24: 529-536.
Matsumiya M., Mochizuki A. (1996) Distribution of chitinase and B-N-acetylhexosaminidase in the organs of several fishes. Fisheries Science 62(1): 150-151.
Mohan M., Bhanja S.K., Basade Y. (2009) Performance of chitin incorporated diet on the indigenous Kumaon Himalayan fishes: snow trout, Schizothorax richardsonii (Gray) and golden mahseer, Tor putitora (Hamilton). Indian Journal of Fisheries 56(2): 135-137.
Nazir I., Chauhan R. S. (2018) Evaluation of dietary utilization of phytobiotics along with vitamin c and chitosan and its impact on growth in fingerlings of Cyprinus carpio haematopterus. Pharma Innov. J 7(8): 281-285.
Olsen R.E., Suontama J., Langmyhr E., Mundheim H., Ringo E., Melle W., Malde M.K., Hemre G.-I. (2006) The replacement of fish meal with Antarctic krill, Euphausia superba in diets for Atlantic salmon, Salmo salar. Aquaculture Nutrition 12: 280-290.
Ravi Kumar M.N.V. (2000) A review of chitin and chitosan applications. Reactive and functional polymers 46(1): 1-27.
Rimoldi S., Ceccotti C., Brambilla F., Faccenda F., Antonini M., Terova G. (2023) Potential of shrimp waste meal and insect exuviae as sustainable sources of chitin for fish feeds. Aquaculture 567: 739256
Ringø, E., Zhou Z., Olsen R.E., Song S.K. (2012) Use of chitin and krill in aquaculture–the effect on gut microbiota and the immune system: a review. Aquaculture Nutrition 18(2): 117-131.
Shiau, S.-Y., Yu Y.-P. (1999) Dietary supplementation of chitin and chitosan depresses growth in tilapia, Oreochromis niloticus × O. aureus. Aquaculture 179(1-4): 439-446.
Tsigos I., Martinou A., Kafetzopoulos D., Bouriotis V. (2000) Chitin deacetylases: new, versatile tools in biotechnology. Trends in biotechnology 18(7): 305-312.
Vervaet A. (2019) Assessing the presence of chitinases in the digestive tract and their relationship to diet and morphology in freshwater Fish. Diss. Ghent University.
Zhang X., Yuan J., Li F., Xiang J. (2021) Chitin synthesis and degradation in crustaceans: a genomic view and application. Marine Drugs 19: 153.
Zhao Y., Park R.-D., Muzzarelli R.A.A. (2010) Chitin deacetylases: properties and applications. Marine Drugs 8: 24-46.


 English
English Español
Español